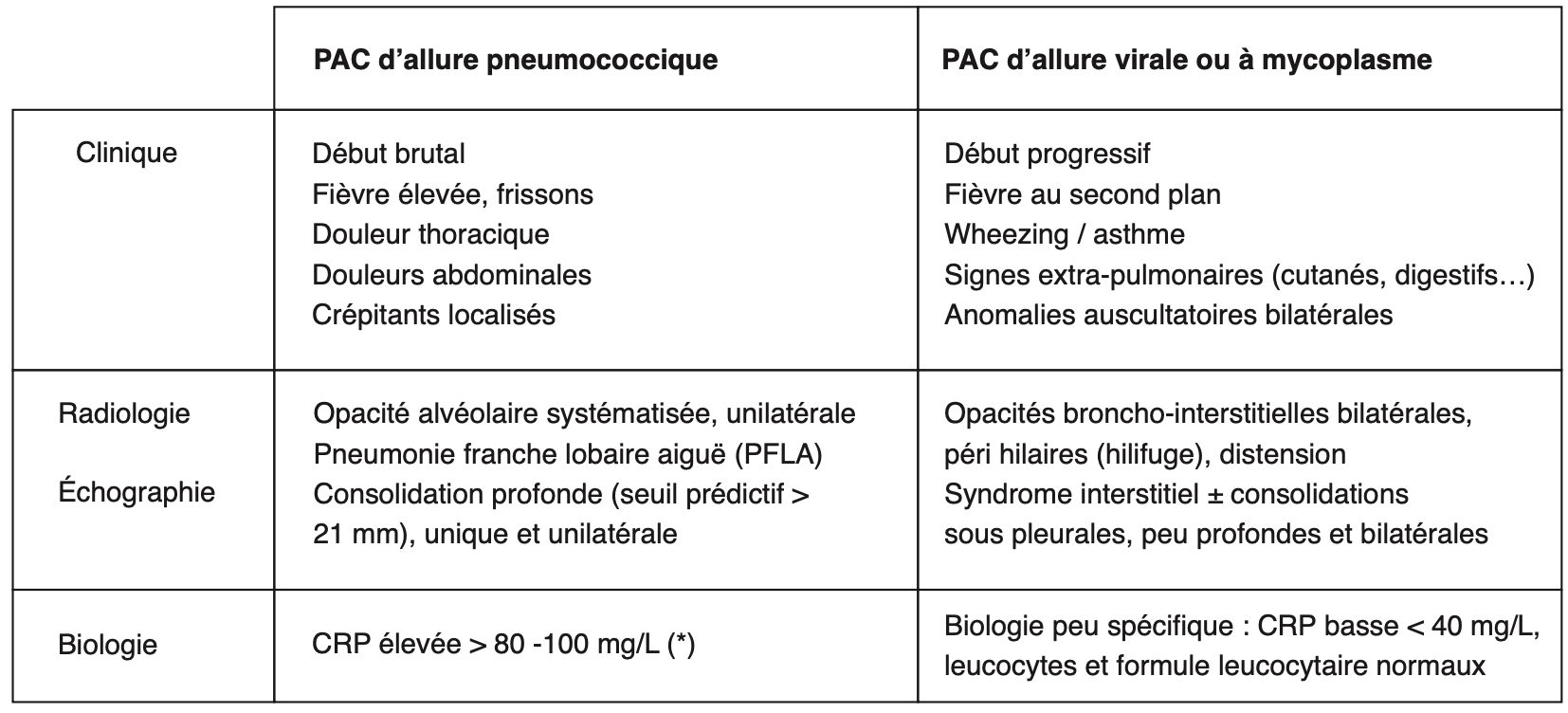
!!! Aucun critère clinique, radiologique ou biologique ne permet de différencier une origine virale d’un germe atypique de type mycoplasme, sauf l’âge (< 5 ans = plutôt viral, ≥ 5 ans = plutôt mycoplasme). Parfois, les pneumonies virales et à mycoplasme peuvent mimer une PFLA.
*CRP : ce critère a une faible valeur prédictive positive et une meilleure valeur prédictive négative.
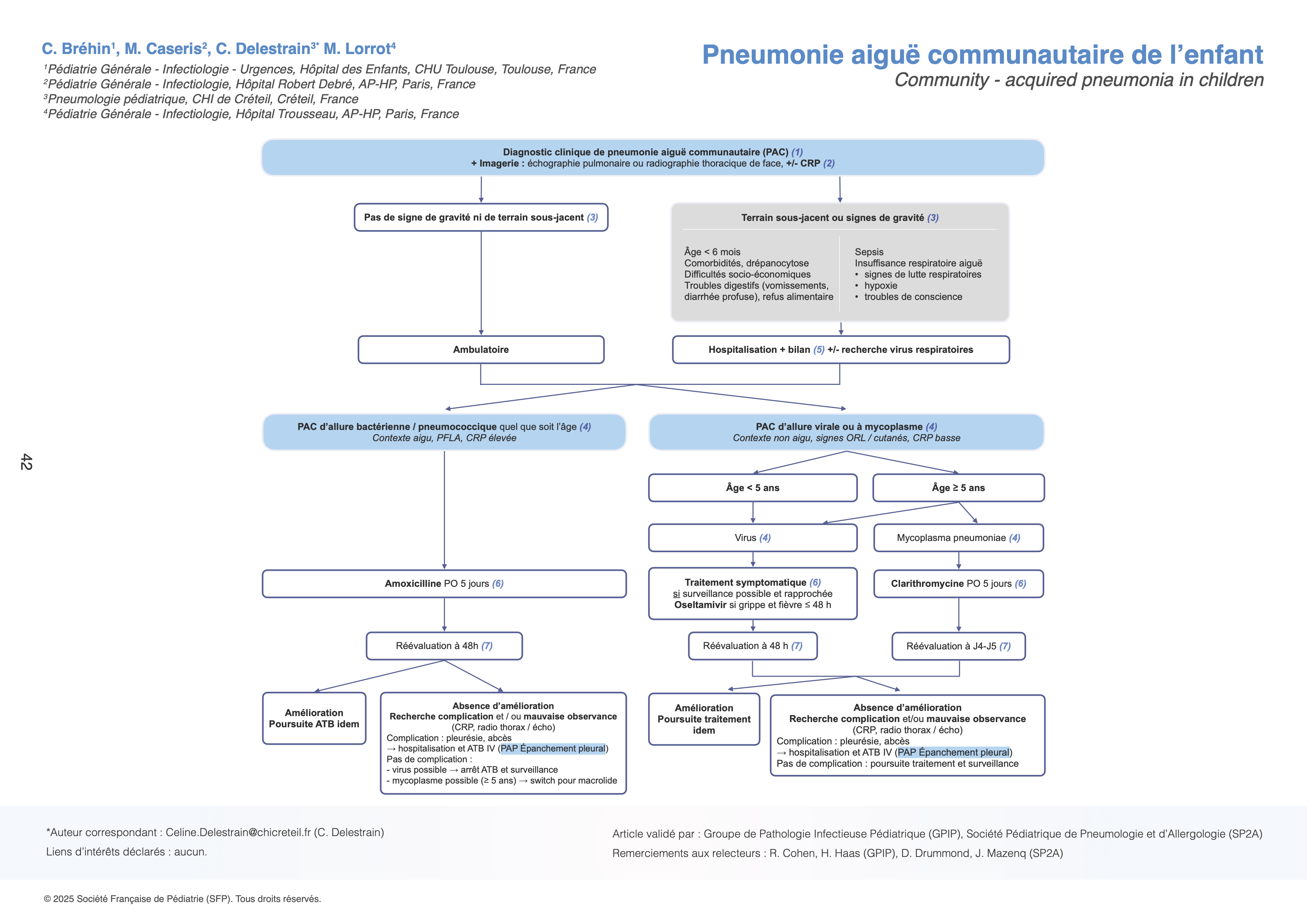
(5) En cas d’hospitalisation, le bilan paraclinique comprend : NFS-plaquettes, hémoculture, CRP. Les tests antigéniques ou moléculaires (syndromiques ou tests d’amplification des acides nucléiques TAAN) sur prélèvement nasopharyngé peuvent être proposés en période épidémique pour le diagnostic des infections respiratoires (VRS, grippe, SARS-CoV2) si le résultat est susceptible de modifier le traitement ou de décider d'un isolement en cas d'hospitalisation. En cas de suspicion de PAC à Mycoplasma pneumoniae, sa recherche par PCR sur aspiration nasopharyngée peut aider au diagnostic (non remboursée en ville et effectuée seulement à l’hôpital) mais une PCR positive ne permet pas de différencier le portage pharyngé de l’infection à Mycoplasma pneumoniae. La sérologie permet le diagnostic (rétrospectif) d’infection à Mycoplasma pneumoniae en cas d’apparition des IgM +/- des IgG 3 semaines après une première sérologie négative. A noter que les IgM peuvent persister très longtemps après une infection aiguë.
(6) La prise en charge thérapeutique, avec antibiothérapie ou non, dépend avant tout de l’étiologie suspectée. Les recommandations du Groupe de Pathologie Infectieuse Pédiatrique (GPIP) pour l’antibiothérapie de première intention des infections respiratoires basses, et les alternatives en cas d’allergie, ont été remises à jour en 2023.
Avant l’âge de 3 ans (nouveau-né exclu), la cause virale prédomine mais une co-infection bactérienne est fréquente justifiant selon le tableau d’une antibiothérapie par amoxicilline. Quel que soit l’âge, la cible à privilégier pour l’antibiothérapie est le pneumocoque même si l’enfant est correctement vacciné. Mycoplasma pneumoniae est principalement incriminé chez les enfants âgés de plus de 5 ans. Le traitement probabiliste recommandé de la pneumonie d’allure pneumococcique est l’amoxicilline (voie orale) : 80 à 100 mg/kg/j (maximum 3 g/jour) en 2 prises. La durée du traitement est de 5 jours en cas d’amélioration clinique rapide. Les critères d'efficacité sont : apyrexie rapide (48 heures) et amélioration des signes respiratoires. Si ce n'est pas le cas, lors de la réévaluation clinique, on évoquera principalement une complication (épanchement para-pneumonique, abcès, empyème : à rechercher par une nouvelle imagerie), une pneumonie virale et/ou à un germe atypique si l’enfant est âgé de plus de 5 ans.
Le traitement probabiliste recommandé de la pneumonie d’un enfant âgé de plus de 5 ans avec arguments pour un germe atypique est la clarithromycine (voie orale) 15 mg/kg/j (maximum 500 mg x2/jour) en 2 prises avec une durée de traitement de 5 jours, ou en alternative, l’azithromycine 20 mg/kg/j (max 500 mg) en 1 prise quotidienne avec une durée de traitement de 3 jours.
En cas de pleuro-pneumopathie, l’enfant est hospitalisé pour débuter une antibiothérapie intraveineuse probabiliste ciblant le pneumocoque, le streptocoque de groupe A et S. aureus, avec de l’amoxicilline acide clavulanique à la posologie de 150 mg/kg/j en 3 injections (PAP Épanchement pleural liquidien chez l’enfant).
En cas de pneumonie avec critères de gravité orientant vers une infection à Staphylococcus aureus ou à Streptococcus pyogenes, l’antibiothérapie probabiliste recommandée est amoxicilline acide clavulanique IV 150 mg/kg/j en 3 injections (dose max 6 g/jour d’amoxicilline) + vancomycine IV 60 mg/kg/j (4 injections d’une heure ou en perfusion continue après une dose de charge de 15 mg/kg sans dépasser 10 mg/min, dose max 4 g/jour) + clindamycine IV 40 mg/kg/j en 3 injections (dose max 2.4 g/jour). Le traitement antibiotique sera adapté aux résultats de la bactériologie à 48 heures.
En cas de pneumonie d’allure virale, la prise en charge est avant tout symptomatique. En cas d’étiologie à virus influenzae (grippe), un traitement curatif par oseltamivir peut être prescrit si les symptômes évoluent depuis moins de 48 heures, d’autant plus que la grippe survient chez un enfant avec terrain médical sous-jacent (immunodéprimé, drépanocytose, pathologie chronique respiratoire, cardiaque ou neuromusculaire).
Les AINS ne sont pas recommandés pour la prise en charge de la fièvre et/ou de la douleur, car susceptibles de favoriser la survenue d’un épanchement pleural.
(7) Une réévaluation clinique est recommandée. L’apyrexie est attendue en 48h pour une pneumonie à pneumocoque, en 3 à 5 jours en moyenne pour une pneumonie virale ou à germe atypique.
En cas de persistance de la fièvre au bout de 48 heures de traitement d’une PAC par amoxicilline, il faut rechercher une explication reliée au traitement (mauvaise compliance, non-prise en raison de vomissements, erreur de posologie) et/ou une complication à l’imagerie thoracique (épanchement para-pneumonique, abcès, empyème,) ou une autre étiologie infectieuse. En cas d’étiologie virale évoquée, l’antibiothérapie pourra être arrêtée selon les cas avec une surveillance. Chez un enfant âgé de plus de 5 ans, en l’absence de complication, il est recommandé d’arrêter l’amoxicilline et de switcher l’antibiothérapie par un macrolide dans l’hypothèse d’une PAC à Mycoplasma pneumoniae.
Si la décision initiale a conduit à un traitement symptomatique de la PAC sans antibiothérapie dans l’hypothèse d’une PAC virale, la réévaluation médicale doit systématiquement être effectuée à 48 heures ; et si la prise en charge est ambulatoire, des consignes re-consultation en urgence doivent être expliquées aux parents en cas d’aggravation secondaire. En l’absence d’amélioration, il faut également rechercher une explication reliée à la prise en charge et une complication à l’imagerie thoracique. Selon la réévaluation clinico-radio-biologique, en l’absence de pleurésie ou abcès, une autre orientation infectieuse peut être évoquée et la conduite thérapeutique adaptée.
En cas de présentation typique de PAC et d’évolution favorable chez un enfant sans pathologie pulmonaire chronique sous-jacente, il n’est pas recommandé de faire un contrôle de l’imagerie thoracique y compris à distance pour un 1er épisode de pneumonie. La pneumonie à pneumocoque n’induit pas généralement de séquelles à long terme. Les pneumonies virales ou à Mycoplasma pneumoniae peuvent être responsables d’une hyperréactivité bronchique résiduelle avec toux prolongée et, rarement de séquelles infectieuses bronchiques (bronchiectasies, bronchiolite oblitérante post infectieuse).
En cas de présentation atypique, d’évolution atypique avec des symptômes qui se chronicisent, ou de récidive dans le même territoire, il faudra s’assurer de l’absence de pathologie sous-jacente et de diagnostic différentiel. L’examen de première intention sera une tomodensitométrie thoracique avec injection de produit de contraste. Elle permettra de rechercher d’une part si une anomalie bronchique n’est pas responsable de la persistance/récidive de la pneumonie, telle qu’un obstacle intraluminal (corps étranger, granulome de mycobactérie, tumeur endobronchique), une compression extrinsèque de la bronche (adénopathie, tumeur, malformation), ou une dilatation des bronches (mucoviscidose, dyskinésie ciliaire, déficit immunitaire). Et d’autre part si l’opacité initialement interprétée comme une pneumonie n’était pas plutôt l’un de ses diagnostics différentiels : adénopathie, malformation, ou tumeur. Chez les enfants ayant au moins 2 pneumonies sur un an, un bilan immunitaire de première intention est également recommandé.
Conclusion
La pneumonie est une des infections les plus fréquentes en pédiatrie et le traitement est le plus souvent effectué en ambulatoire. Devant une suspicion clinique de pneumonie, l’imagerie thoracique (échographie ou radiographie) est nécessaire pour confirmer le diagnostic.
L’antibiothérapie n’est pas systématique si l’étiologie virale est retenue, sans surinfection bactérienne. Le traitement d’une pneumonie d’allure pneumococcique par amoxicilline est urgent, avec une durée raccourcie à 5 jours. Dans tous les cas de pneumonie, il est nécessaire de réévaluer l’enfant. En cas d’évolution favorable, un contrôle radiologique à distance d’un premier épisode de pneumonie n’est pas systématique.
La prévention des pneumonies bactériennes des jeunes enfants est effectuée grâce à la vaccination contre le pneumocoque et Hib de tous les nourrissons selon les schémas vaccinaux du calendrier vaccinal en vigueur. La généralisation du nirsevimab aux nourrissons de moins de 1 an va très probablement modifier l’épidémiologie des pneumonies des nourrissons dans les années à venir.