Vous êtes ici
Thématique:
Pilosité pubienne précoce chez l’enfant
![]()
L. Jozwiak
Endocrinologie pédiatrique, Hôpital Jeanne de Flandre – CHU de Lille, France*Auteur correspondant - Adresse e-mail : luciejozwiak@gmail.com (L. Jozwiak). Cliquez sur l'image pour l'agrandir.
| Article validé par : | |
|
SFEDP (Société Française d’Endocrinologie et Diabétologie Pédiatrique) |
|
| Remerciements aux relecteurs : | |
|
P. Barat L. Martinerie R. Reynaud (SFEDP) |
|
Introduction
La pilosité pubienne chez la fille débute habituellement quelques mois après le début de la puberté (caractérisé par le début du développement mammaire), mais peut parfois précéder le développement mammaire. L’âge physiologique se situe entre 8 et 13 ans.
Chez le garçon la pilosité pubienne apparait environ 6 mois après le début de la puberté (caractérisé par l’augmentation du volume testiculaire au-delà de 4 mL). L’âge physiologique se situe entre 9 et 14 ans.
On parle donc de pilosité pubienne précoce devant un stade de Tanner P2 apparu avant l’âge de 8 ans chez la fille et de 9 ans chez le garçon.
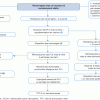
Démarche diagnostique devant une pilosité pubienne précoce
(1) Il faut avant tout rechercher des signes de démarrage pubertaire : chez la fille le développement des seins (S2) et chez le garçon le développement des testicules au-delà de 4mL (G2). S’ils sont présents, la démarche diagnostique est celle du Pas-à-Pas Puberté précoce.
(2) L’existence d’une pilosité axillaire associée ou non à la pilosité pubienne ne modifie pas le raisonnement médical. Le raisonnement médical est le même en cas de pilosité axillaire isolée.
(3) Les signes cliniques d’hyper-androgénie à rechercher sont : acné, sudation malodorante dans les deux sexes, hypertrophie clitoridienne chez la fille, augmentation de la taille de la verge et/ou modification du scrotum chez le garçon.
(4) La courbe de croissance doit systématiquement être tracée, afin de rechercher une accélération staturale. La vitesse de croissance annuelle doit être calculée à partir de 2 mesures espacées d’au moins 6 mois, et comparée aux normes pour l’âge : en période pré pubertaire, dès l’âge de 4 ans, la vitesse de croissance normale est de 5 à 6 cm par an.
(5) Il faudra à l’examen clinique rechercher des signes d’hypercorticisme : faciès cushingoïde, prise de poids, bosse de bison, vergetures, HTA.
Cette analyse clinique doit être complétée par plusieurs examens complémentaires systématiques :
(6) Détermination de l’âge osseux : radiographie du poignet et de la main gauche de face (selon Greulich et Pyle). L’avance d’âge osseux est considérée comme significative lorsqu’elle est supérieure ou égale à deux ans par rapport à l’âge civil. En dessous de deux ans d’avance d’âge osseux par rapport à l’âge civil, on considère que l’âge osseux et l’âge civil sont corrélés.
(7) Recherche d’une hyper-androgénie biologique : 17-OHProgestérone, SDHEA, Delta4-androstènedione, Testostérone.
La 17-OH-progestérone est synthétisée par la glande surrénale. En absence de pathologie surrénalienne, son taux de base doit être inférieur à 2 ng/mL. Son taux suit le rythme circadien du cortisol et de l’ACTH.
Le SDHEA est synthétisé uniquement par la glande surrénale, et son taux ne varie pas au cours du nycthémère.
Le Delta4-androstènedione est synthétisé par la glande surrénale, l’ovaire et le testicule ; son taux suit le rythme nycthéméral du cortisol.
La Testostérone est synthétisée dans les tissus périphériques à partir des androgènes surrénaliens, mais aussi par l’ovaire et le testicule. Il existe également un rythme circadien de sécrétion.
Aussi, pour évaluer de manière optimale le niveau de production de ces androgènes, leur dosage doit être réalisé préférentiellement le matin à 8 h.
Au terme de ces explorations, plusieurs diagnostics sont à évoquer.
(8) La prémature pubarche est un diagnostic d’élimination chez un enfant qui ne présente ni signe d’hyperandrogénie, ni accélération de la vitesse de croissance, ni avance de maturation osseuse. Cela correspond à une activation précoce mais non pathologique de la glande surrénale. Le SDHEA peut être un peu augmenté et de manière isolée, en rapport avec le stade de pilosité pubienne. Elle est fréquente chez les enfants qui ont un antécédent de RCIU, et notamment chez ceux avec un rattrapage pondéral rapide au cours de la première année de vie.
(9) Une forme non classique d’hyperplasie congénitale des surrénales (HCS) est due à un bloc enzymatique surrénalien avec une activité enzymatique résiduelle. La première étiologie d’HCS est le bloc en 21-Hydroxylase. Dans sa forme classique, ce bloc surrénalien s’exprime dès la naissance par une virilisation des petites filles, plus ou moins un syndrome de perte de sel dans les deux sexes. Dans sa forme non classique, il peut s’exprimer dans les deux sexes par une prémature pubarche progressive et d’expression plus tardive. La prévalence de la forme non classique est de 0,1 à 0,2 %. Initialement, l’élévation des androgènes, l’avance d’âge osseux et l’accélération de la vitesse de croissance peuvent être peu marquées. Un taux de 17OH-progestérone de base > 5 ng/ mL permet d’affirmer le diagnostic, une valeur entre 2 et 5 ng/ ml doit faire discuter une forme non classique ou une hétérozygotie. Un taux de 17OH-progestérone de base < 2 ng/mL est peu évocateur mais ne permet pas toujours d’éliminer le diagnostic. Il conviendra alors de demander un avis spécialisé et de discuter en cas de signes associés (avance d’âge osseux, accélération de la vitesse de croissance) un test fort au Synacthène® : un taux de 17 OH-progestérone < 10 ng/mL après stimulation permet d’éliminer le diagnostic d’hyperplasie congénitale des surrénales.
Le bloc en 11-hydroxylase, plus rare, peut donner dans sa forme non classique, une prémature pubarche dont le diagnostic peut nécessiter un test au Synacthène® fort.
(10) Une élévation isolée de la Testostérone est en faveur d’une prise exogène de testostérone, à rechercher à l’interrogatoire.
(11) Le corticosurrénalome est une tumeur surrénalienne maligne, d’évolution clinique rapide, qui représente 0,2 % des cancers pédiatriques.
Cette tumeur est plus fréquente chez la fille. Elle se présente dans la majorité des cas par un excès d’androgènes associé ou non à un excès de glucocorticoïdes, et d’oestrogènes. Il conviendra de réaliser en plus des androgènes surrénaliens un dosage de l’Estrone, 17β-oestradiol (si gynécomastie associée) et du cortisol libre urinaire des 24 heures. L’examen clinique recherchera des signes d’hypercorticisme (faciès cushingoïde, prise de poids, bosse de bison, vergetures, HTA). La symptomatologie est d’évolution rapide. Il peut également exister des blocs enzymatiques intra-tumoraux avec une élévation de la 17OH-progestérone associée.
L’échographie abdomino-pelvienne, plus facile d’accès en première intention, permet le diagnostic de masses surrénaliennes volumineuses. Si l’échographie est normale mais qu’il existe une suspicion de pathologie surrénalienne, il faut réaliser une TDM ou une IRM.
(12) Les tumeurs ovariennes et les tumeurs testiculaires sont responsables du développement d’une pilosité pubienne associée ou non à des signes de développement pubertaire. Les gonades secrètent en excès des androgènes et/ou des oestrogènes. Le tableau clinique peut être celui d’une puberté précoce périphérique. Une gynécomastie peut être un point d’appel chez le garçon.
Les tumeurs secrétant de l’HCG sont également responsables d’un tableau clinique de puberté précoce périphérique, l’HCG se fixant au récepteur de la LH.
Conclusion
Le développement isolé d’une pilosité pubienne précoce doit faire éliminer en priorité une pathologie surrénalienne maligne (corticosurrénalome) ou enzymatique (hyperplasie congénitale de forme non classique) et une tumeur gonadique.
Le diagnostic de prémature pubarche reste un diagnostic d’élimination, et il conviendra de maintenir une surveillance clinique régulière (stade de Tanner, signe clinique d’hyper androgénie, vitesse de croissance) au moins deux fois par an chez ces patients et de remettre en question ce diagnostic selon l’évolution clinique. Une puberté précoce ou avancée d’origine centrale peut également se développer dans les suites d’une prémature adrénarche.
De même il existe un risque accru de développer ultérieurement un syndrome des ovaires polykystiques.
Remerciements
Cet article fait partie du numéro supplément « Pas à Pas 2020 » réalisé avec le soutien institutionnel des sociétés Gallia, Procter & Gamble et Sanofi Pasteur.
Liens d’intérêts
Aucun


Références
Beltrand J, Polak M. Puberté normale et pathologique. EMC – Traité de Médecine Akos 2016;11(2):1-7 [Article 3-0721].
Brauner R. Puberté pathologique. EMC – Pédiatrie 2013;8(2):1-11 [Article 4-107-B-15].
Bachelot A, Bidet M, Wautier A, Bellanné-Chantelot C, Touraine P. Forme non classique d’hyperplasie congénitale des surrénales par déficit partiel en 21-Hydroxylase. EMC – Endocrinologie-Nutrition 2017;14(2) :1-8 [Article 10-015-B-25].
Oudet B., Rigabert J., Young J., Raffin-Sanson M.-L. Physiologie et exploration des sécrétions de cortisol et d’androgènes par la surrénale. EMC (Elsevier Masson SAS, Paris), Endocrinologie-Nutrition, 10-014-B-10, 2010.
Xu Y-Q, Li G-M, Li Y. Advanced bone age as an indicator facilitates the diagnosis of precocious puberty. J Pediatr (Rio J). 2018;94:69–75.