Vous êtes ici
Thématique:
Hépatite virale C
P. Brouéa,b, C. Riveta,c
aGroupe Francophone d’Hépatologie Gastroentérologie et Nutrition Pédiatrique bHépatologie Pédiatrique et Maladies Héréditaires du Métabolisme, Hôpital des Enfants, CHU Toulouse, 330 av de Grande-Bretagne, 31059 Toulouse Cedex, France cHépatogastro-entérologie et Nutrition Pédiatrique, Hôpital Mère-Enfant, CHU Lyon, 59 bd Pinel, 69677 Bron Cedex, France Auteur correspondant - Adresse e-mail : broue.p@chu-toulouse.frArbre décisionnel – Commentaires
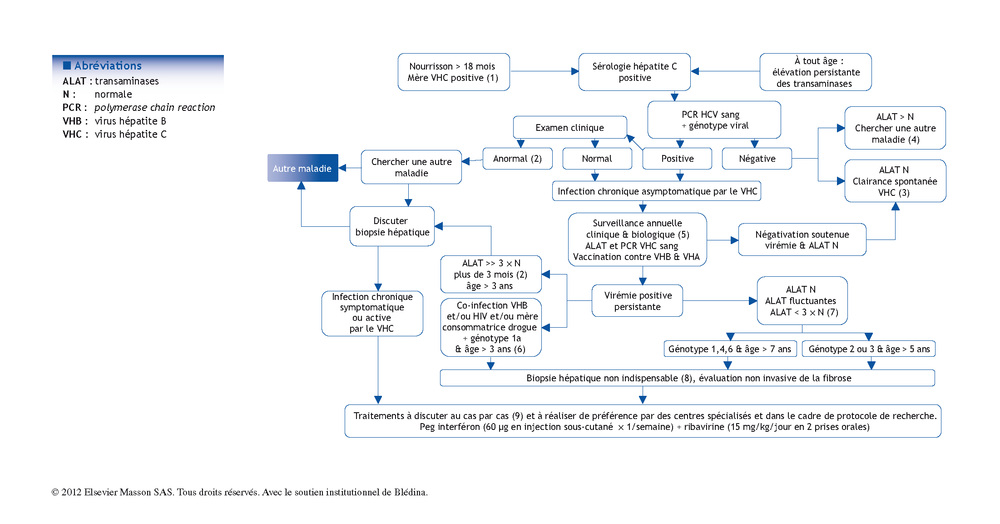
(1) En 2012, l’enfant est essentiellement contaminé par le virus de l’hépatite C (VHC) par sa mère infectée au moment de la naissance [1]. Le risque est < 5 %. Après la naissance, les anticorps maternels anti-hépatite C sont détectables chez l’enfant jusqu’à 18 mois et non différentiables de ceux éventuellement produits par le nourrisson. Il n’y a aucune urgence à diagnostiquer la contamination d ’un nourrisson par le virus de l’hépatite C.
Si l’on souhaite dépister une éventuelle contamination avant l’âge de 18 mois (donc en dehors des recommandations), il ne faut pas demander la sérologie mais une virémie par PCR.
(2) L’infection par le VHC ne génère pas d’anomalie clinique ni de manifestation extra-hépatiques chez l’enfant mais quelques hépatomégalies modérées ont été décrites [1]. Habituellement, les perturbations du bilan hépatique sont soit absentes, soit modérées et fluctuantes [1]. En cas de présentation clinique ou biologique inhabituelle, il faut penser à rechercher une autre maladie.
(3) La clairance spontanée du VHC est un événement qui survient plus souvent que chez l’adulte et pourrait concerner jusqu’à 30 % des enfants. Les chances d’élimination du VHC sont plus élevées dans les 3 premières années de vie et pour les infections par le génotype 3 mais deviennent improbables après l’âge de 7 ans [1]. La clairance est définie par une normalisation du bilan hépatique et une négativité de la virémie sur 3 contrôles successifs en 6 mois. Les Ac anti-VHC peuvent rester positifs plusieurs années au décours.
(4) En conséquence, en présence de perturbations du bilan hépatique avec une sérologie hépatite C positive et une virémie négative, il faut poursuivre les investigations étiologiques.
(5) Chez l’enfant, la progression de la fibrose est plus lente que chez l’adulte. Les biopsies hépatiques indiquent des lésions minimes [2]. Après l’adolescence, la progression de la fibrose reste plus lente en cas de contamination en âge pédiatrique en l’absence de consommation d’alcool. Ainsi, l’hépatite virale C apparaît comme une maladie pédiatrique relativement bénigne. La surveillance annuelle a pour but d’identifier des évolutions inhabituelles et la possibilité d’élimination spontanée du VHC dans les premières années de vie. Il est important de réaliser une vaccination contre les virus des hépatites B et A puis de déconseiller toute consommation d’alcool à partir de l’adolescence. Il n’y a pas de risque d’hépatocarcinome en l’absence de cirrhose [1]. Les tests sanguins de fibrose ne peuvent pas être transposés chez l’enfant. La surveillance par Fibroscan® n’est pas encore validée chez l’enfant mais représente un espoir sérieux de surveillance non invasive de la fibrose.
(6) L’existence d’une co-infection par le virus de l’hépatite B, le virus VIH, ou le fait que la mère soit consommatrice régulière de drogues avec un VHC génotype 1a ont été identifiés comme des facteurs pouvant accélérer la vitesse de formation de fibrose et s’associer à un risque de cirrhose en période pédiatrique [1].
Il en est de même des maladies nécessitant des transfusions multiples et répétées (risque d’hémochromatose secondaire) ou des maladies chroniques du foie.
(7) Le risque de cirrhose est < 2 % et concerne des circonstances particulières. Il est de règle de poursuivre simplement la surveillance annuelle. Des traitements sont possibles mais exposent à des effets secondaires réguliers et des résultats variables alors que la maladie est asymptomatique et progresse peu.
Les indications thérapeutiques doivent donc être discutées au cas par cas en l’absence de facteur de risque particulier [3]. En cas d’infection par un VHC de génotype 2 ou 3, les chances d’éradication sont proches de 90 % avec un traitement de 6 mois. Dans les autres génotypes, l’efficacité n’est que de 50 % avec un traitement de 1 an.
(8) En l’absence de signe de cirrhose ou de doute sur une autre maladie, il n’est pas indispensable d’appuyer une décision thérapeutique sur une biopsie hépatique.
(9) Le traitement est une bithérapie et doit être étroitement surveillé par un médecin entraîné [3]. Il doit être précédé d’un bilan qui élimine les maladies auto-immunes et s’assure de l’absence d’anomalie thyroïdienne. La surveillance est étroite surtout dans les 3 premiers mois pour détecter des complications hématologiques ou une mauvaise tolérance clinique qui peuvent conduire à moduler les doses d’interféron et/ou de ribavirine. En cas de virémie positive ou de diminution insuffisante de la réplication virale, le traitement doit être interrompu après 3 mois. La durée de traitement sera de 1 an en cas de VHC génotype 1, 4, 6 ou 3 à réplication élevée mais réduite à 6 mois en cas de VHC de génotype 2 ou 3 à réplication faible. La tolérance générale de ce traitement est meilleure chez l’enfant que chez l’adulte.
Liens d'intérêts
P. Broué : Essais cliniques : en qualité d’investigateur principal, coordonnateur ou expérimentateur principal (Schering-Plough, Merck).
C. Rivet : aucun conflit d’intérêts pour cet article.


Références
[1] Bortolotti F, Verucchi G, Cammà C, et al. Long-term course of chronic hepatitis C in children: from viral clearance to end-stage liver disease. Gastroenterol 2008;134:1900-7.
[2] Iorio R, Verrico A, Giannattasio A. Is liver biopsy mandatory in children with chronic hepatitis C? World J Gastroenterol2007;13:4025-6.
[3] Mohan N, González-Peralta RP, Fujisawa T, et al. Chronic Hepatitis C virus infection in children. J Pediatr Gastroenterol Nutr 2010;50:123-31.