Vous êtes ici
Thématique:
Purpura rhumatoïde chez l’enfant
![]()
A. Lefèvre-Utile1, S. Eyssette-Guerreau2
1Service de pédiatrie, département Femme-mère-enfant, Centre hospitalier universitaire Vaudois (CHUV), faculté de biologie et de médecine (FBM) de l’Université de Lausanne (UNIL), Suisse 2Service de pédiatrie, Centre hospitalier de Pontoise et MSP La Colombe, France *Auteur correspondant - Adresse e-mail : alain.lefevre-utile@chuv.ch (A. Lefèvre-Utile). Cliquez sur l'image pour l'agrandir.| Article validé par : | |
|
Groupe Francophone d’Hépatologie-Gastroentérologie et Nutrition Pédiatriques (GFHGNP) Groupe de Pédiatrie Générale, sociale et environnementale (GPGse) Société Française de Dermatologie Pédiatrique (SFDP) Société de Néphrologie Pédiatrique (SNP) Société Francophone de Rhumatologie et de Maladie Inflammatoire Pédiatrique (SOFREMIP) |
|
Introduction
Le purpura rhumatoïde (PR) est la première vascularite pédiatrique avec une incidence annuelle proche de 20 cas pour 100 000 enfants, et un pic de survenue entre 4 et 7 ans. Les Anglo-Saxons parlent de purpura de Henoch-Schönlein, mais le terme de vascularite à immunoglobulines A (IgA) est à privilégier. Contrairement à l’adulte où la cause est souvent secondaire, elle reste en général mal connue chez l’enfant. Il s’agit d’une inflammation vasculaire systémique des petits vaisseaux en rapport avec les dépôts de complexes immuns contenant des IgA. Les principaux organes atteints sont la peau, les reins, le système digestif et les articulations. Deux des enjeux majeurs sont de dépister l’atteinte rénale et d’organiser la surveillance.
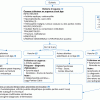
Conduite à tenir devant un purpura rhumatoïde
Démarche diagnostique
(1) Le diagnostic se fait selon les critères EULAR/PRINTO/PRES (tableau 1)
| Critère majeur Purpura vasculaire Associé à au moins un des critères suivants Douleur abdominale Arthralgie ou arthrite Atteinte rénale glomérulaire (protéinurie, hématurie, insuffisance rénale) Vascularite leucocytoclasique avec dépôts d’IgA ou glomérulonéphrite proliférative avec dépôts d’IgA à l’histologie. |
L’éruption typique de purpura vasculaire dans le cadre d’un PR (figures 1 et 2) est composée de macules érythémateuses, de taille variable, pétéchiales à ecchymotiques. Elle comporte une composante nécrotique (non rapidement extensive) la rendant palpable puis croûteuse. Elle prédomine dans les zones de déclivité : les membres inférieurs, les fosses lombaires, et les fesses. Elle est liée à l’extravasation de sang dans le derme à la suite de l’inflammation des petits vaisseaux. Il est parfois difficile de faire la différence avec le purpura lié à un trouble de l’hémostase. Dans ce cas, une numération formule sanguine (absence de thrombopénie) et un bilan d’hémostase (attendu normal) peuvent aider à l’orientation.

Figure 1. Éruption purpurique déclive : membres inférieurs en position debout, et fesses en position allongée. (photo fournie par A. Lefèvre-Utile)

Figure 2. Éruption purpurique vasculaire avec éléments nécrotiques (infiltrés, croûteux). (photo fournie par A. Lefèvre-Utile)
(2) Les diagnostics différentiels de purpura vasculaire en pédiatrie sont évoqués avant tout sur la clinique. Du fait de sa sévérité, le purpura fulminans doit être rapidement éliminé (purpura avec au moins 1 élément nécrotique, d’extension rapide, sepsis associé, voir PAP Purpura). Le purpura peut être para-infectieux (associé avec une symptomatologie infectieuse bien tolérée), post-médicamenteux, ou révélateur d’une autre vascularite systémique (lupus, vascularite à ANCA). Chez l’enfant âgé de moins de 3 ans, le purpura rhumatoïde est rare mais il existe une autre vascularite avec dépôts d’IgA : l’oedème aigu hémorragique du nourrisson, dont la prise en charge est moins codifiée et n’est pas traitée dans ce PAP.
Les indications d’un avis dermatologique pour discuter du recours à la biopsie cutanée sont à connaître (tableau 2). Celle-ci permet d’argumenter un diagnostic différentiel et doit se faire sur la lésion la plus récente.
| Lésions de localisations atypiques : non déclives ou diffuses Évolution atypique : aggravation continue, chronicisation sur plusieurs mois Signes clinicobiologiques évocateurs d’autres vascularites Âge atypique < 3 ans et > 15 ans |
La biopsie retrouve classiquement une vascularite leucocytoclasique avec des dépôts périvasculaires d’IgA. Attention, l’absence des dépôts d’IgA n’infirme pas formellement le diagnostic.
Évaluation des atteintes initiales et de leur gravité
(3) L’atteinte rénale est fréquente, autour de 20 à 50 % des cas chez l’enfant, parfois retardée, et d’intensité variable, généralement modérée. Les signes physiques à type d’HTA (hypertension artérielle) et d’oedèmes sont rares ; la néphropathie du purpura rhumatoïde peut ainsi passer inaperçue. Elle doit donc être systématiquement recherchée : contrôle de la pression artérielle, estimation de la fonction rénale et dépistage d’une hématurie et/ou d’une protéinurie par bandelette urinaire (BU) avec recours à des analyses complémentaires si nécessaire. Elle peut se manifester par une protéinurie (BU : si protéines ≥ 2+, confirmer avec rapport protéinurie/créatininurie P/C > 20 mg/mmol sur les premières urines du matin), une hématurie (BU : GR [globules rouges] ≥ 2+ ou ≥ 10/mm3), une insuffisance rénale (DFG [débit de filtration glomérulaire] < 90 ml/min/1,73 m2), voire prendre la forme d’un syndrome néphrotique ou néphritique. L’hématurie, au moins microscopique, est quasi constante dans la néphropathie du purpura rhumatoïde, mais ne nécessite pas de biopsie ni de traitement si elle est isolée sans protéinurie ni insuffisance rénale associée.
(4) Un avis néphrologique pédiatrique doit être rapidement demandé en cas de néphropathie, dès qu’une protéinurie est détectée sur les urines du matin. En effet, c’est la précocité de la prise en charge qui limitera le risque de séquelles rénales.
Les indications de la ponction biopsie rénale (PBR) ne sont pas consensuelles. Un groupe d’experts de l’IPNA (International Pediatric Nephrology Association) recommande la PBR :
• immédiatement en cas de protéinurie néphrotique : rapport P/C > 200 mg/mmol ou 2 mg/mg et a fortiori de syndrome néphrotique (albuminémie < 30 g/L) ;
• immédiatement en cas d’insuffisance rénale aiguë organique (débit de filtration glomérulaire estimé [DFGe] < 90 ml/min/1,73 m2), quel que soit le niveau de protéinurie ;
• en cas de protéinurie modérée persistante (P/C 100-200 mg/mmol ou 1-2 mg/mg) pendant 2-4 semaines.
• en cas de protéinurie minime persistante (P/C 20-50 mg/mmol ou 0,2-0,5 mg/mg) > 4 semaines.
La biopsie a une valeur diagnostique (dépôts d’IgA mésangiaux) et pronostique (pourcentage de croissants, de fibrose tubulo-interstitielle et de sclérose glomérulaire).
(5) L’atteinte abdominale est fréquente (environ 60 %). Elle se manifeste principalement par des douleurs abdominales, mais aussi des rectorragies, un méléna, une anorexie, des vomissements. La douleur abdominale intense ou l’hémorragie digestive doivent faire réaliser une échographie abdominale à la recherche d’atteintes sévères comme l’hématome pariétal, l’invagination iléo-iléale ou iléo-colique. Des atteintes plus rares, telles que péritonéale ou pancréatique, ont été décrites.
(6) L’atteinte articulaire est fréquente (environ 60 %), non destructrice. Elle est caractérisée par des arthralgies, voire des arthrites, uniques ou multiples, souvent localisées au niveau des moyennes et grosses articulations, au voisinage de l’éruption (chevilles, genoux). Elle ne doit pas motiver d’exploration complémentaire sauf s’il y a doute diagnostique.
(7) L’atteinte testiculaire est rare. Elle se caractérise par une orchite inflammatoire uni- ou bilatérale et nécessite classiquement le recours à la corticothérapie. Elle peut se compliquer d’une épididymite, voire d’une torsion. En cas de doute, un avis chirurgical peut être demandé.
Les atteintes menaçant le pronostic vital sont exceptionnelles (vascularite cérébrale, pulmonaire). Elles motivent le recours à un traitement immunosuppresseur puissant et doivent faire évoquer d’autres causes de vascularites systémiques.
Stratégie de prise en charge thérapeutique et suivi
(8) Une fois le diagnostic posé, une prise en charge ambulatoire peut être proposée en l’absence des critères suivants : retentissement fonctionnel important (mise en charge impossible, asthénie majeure, etc.), nécessité d’une antalgie par palier III, atteinte menaçant le pronostic vital, atteinte rénale avec indication d’avis spécialisé urgent. Avant le retour au domicile, le diagnostic, la surveillance et le suivi doivent être expliqués au patient et à sa famille.
Le patient doit être invité à reconsulter : 1) rapidement en cas de sang dans les selles, de douleurs intenses malgré les antalgiques de palier I, de vomissements itératifs et/ou d’une intolérance alimentaire, d’une orchite, 2) au cours de l’évolution en cas de chronicisation, avec répétition et aggravation des poussées sur plusieurs mois, ou en l’absence d’amélioration dans les semaines suivant la première crise. Généralement, la poussée inaugurale s’améliore dans les 10 premiers jours.
(9) La prise en charge symptomatique associe le repos ainsi que des antalgiques avec en première intention le paracétamol. Le phloroglucinol est utile en cas de douleurs abdominales légères. Les AINS (anti-inflammatoires non stéroïdiens), en association avec le paracétamol, sont particulièrement efficaces en cas d’arthralgies invalidantes après avoir vérifié l’absence d’atteinte rénale et d’hémorragie digestive. Selon les cas, l’arrêt du sport peut être préconisé en phase aiguë, avec une reprise progressive, proportionnée à la douleur.
(10) Selon l’intensité de la douleur (principalement abdominale), le recours aux antalgiques de palier III peut être nécessaire. L’abord intraveineux (IV) est à privilégier en cas de douleur abdominale, la vascularite digestive pouvant altérer l’absorption des traitements oraux. Dans ce cas, le patient doit être hospitalisé, et la douleur explorée et soulagée. Le patient pourra rentrer à domicile lorsqu’il sera sevré des paliers III.
(11) Une corticothérapie est indiquée dans de rares cas. Ses modalités varient en fonction de la sévérité de l’atteinte :
a) une corticothérapie orale, à dose modérée (prednisone 1-2 mg/kg/j, maximum 60 mg) et de durée courte (< 10 jours), est indiquée en cas d’orchite, ou de fort retentissement de l’atteinte articulaire. Cette prise en charge peut se faire en ambulatoire et l’arrêt de la corticothérapie ne nécessite pas de palier ;
b) une corticothérapie intraveineuse, à dose modérée (méthylprednisolone 1-2 mg/kg/j, maximum 60 mg) et de durée courte, est indiquée en cas d’atteinte digestive sévère ou ayant un retentissement important (orchite sévère, hyperalgie sévère, etc.). Selon les équipes, des mesures additionnelles comme la mise en place d’une alimentation entérale peut être proposée en cas de douleurs abdominales intenses et/ou de vomissements empêchant l’alimentation orale spontanée. Exceptionnellement, la douleur et/ou les vomissements imposent la mise en place d’une nutrition parentérale continue ;
c) une corticothérapie IV forte dose (méthylprednisolone 10-30 mg/kg/j, maximum 1 g/j), pendant 3-5 jours, peut être mise en place en cas d’atteinte menaçant le pronostic vital ou fonctionnel comme l’hémorragie intra-alvéolaire, l’encéphalite. Cette prise en charge s’applique à des situations exceptionnelles et doit se faire au sein d’un centre expert, à proximité d’une unité de soins intensifs.
(12) Dans des situations exceptionnelles et sévères, le recours à une immunosuppression additionnelle sera discuté en concertation avec les spécialistes.
(13) La surveillance de l’atteinte rénale est centrale une fois que le retour au domicile est décidé ; 85 % des atteintes rénales surviennent dans le premier mois et 97 % dans les 6 premiers mois. Le but est donc de dépister la survenue d’une atteinte rénale différée ou la disparition de la protéinurie dans le cas d’une atteinte initiale. En cas d’atteinte rénale prouvée, le risque de séquelle à long terme est d’environ 2 %, soit 98 % d’évolution favorable. Ce risque est surtout présent chez les enfants avec syndromes néphrotiques ou néphritiques. La majorité de ces enfants récupérant sans séquelle apparente vont toutefois justifier d’une néphroprotection à vie : mesure de la pression artérielle et recherche d’une protéinurie par BU une fois par an chez le médecin traitant, évitement des néphrotoxiques type AINS et adaptation des doses de médicaments à la fonction rénale, alimentation équilibrée. La surveillance rénale est effectuée par les parents, ainsi que par le pédiatre ou le médecin généraliste, selon les modalités précisées dans le tableau suivant. En présence d’une protéinurie, la mise en place d’un traitement néphroprotecteur par inhibiteur de l’enzyme de conversion de l’angiotensine (IEC) ou antagonistes des récepteurs de l’angiotensine II (ARA II) doit être discutée rapidement avec un néphropédiatre, avec une augmentation progressive des doses et sous couvert d’un contrôle régulier de la biologie sanguine (kaliémie, créatininémie). Le traitement de la néphropathie du purpura rhumatoïde repose sur les corticoïdes IV et/ou oraux, parfois associés à des immunosuppresseurs, en fonction de la sévérité, et après avis spécialisé. Le but est d’obtenir une rémission complète (P/C < 20 mg/mmol, fonction rénale normale).
| Sans atteinte rénale initiale | |
| Bandelette urinaire détectant les protéines sur urines du matin | |
| – 2×/sem pendant 1 mois – 1×/sem pendant 2 mois – 2×/mois pendant 3 mois |
Si protéines ≥ 2+ sur deux prélèvements consécutifs : dosage rapport P/C sur urines du matin et contacter néphropédiatre si rapport P/C > 20 mg/mmol |
| Pression artérielle mesurée par le médecin traitant | |
| – J15, 1 mois, 6 mois | |
| En cas d’atteinte rénale initiale avec critères de retour à la maison Si protéinurie initiale légère ou modérée : rechercher les critères de protéinurie persistante selon les mêmes modalités Si hématurie isolée : ajouter bandelette urinaire détectant les globules rouges – 1×/mois pendant 6 mois jusqu’à négativation Durée totale du suivi – 6 mois après la dernière poussée de PR, en l’absence d’atteinte rénale – prolongée en cas d’atteinte rénale (en lien avec spécialiste |
Si l’atteinte rénale secondaire est confirmée, il est important que tout médecin traitant d’un enfant pris en charge en ambulatoire ait les coordonnées d’un pédiatre hospitalier ou d’un néphropédiatre à contacter.
Il n’est pas nécessaire de décaler la vaccination au-delà de la fin d’une poussée.
Conclusion
Le purpura rhumatoïde est un diagnostic souvent posé par le médecin de première ligne, en cabinet ou aux urgences. Cela n’enlève rien au caractère complexe de cette maladie à propos de laquelle l’enfant et les parents peuvent avoir des interrogations légitimes. Il est donc important de prendre le temps de délivrer une information adaptée dès l’annonce diagnostique.
La maladie évolue par poussées principalement cutanées, articulaires ou abdominales, de 4 à 6 semaines. Il s’agit davantage de répliques de la première poussée, volontiers moins intenses, qui peuvent survenir jusqu’à plusieurs mois après la phase inaugurale. Il est recommandé de mettre en place les mêmes mesures que celles appliquées lors de la poussée initiale. La reprise de l’activité physique peut être un facteur déclenchant de ces nouvelles poussées, cela n’indique pas pour autant le repos strict systématique. Le repos et la dispense de sport se décident au cas par cas, selon le retentissement.
L’évolution à long terme est marquée par l’atteinte rénale, dont le pronostic est bon, avec une majorité d’enfants qui vont récupérer sans séquelle apparente, mais justifier d’une néphroprotection àvie.
Le risque de nouvelles poussées au cours de la vie est extrêmement rare et leur survenue doit orienter vers la recherche de diagnostic différentiel, d’autant plus si elles sont sévères, prolongées ou atypiques.
Liens d’intérêts
Les auteurs déclarent ne pas avoir de lien d’intérêt.
Cet article fait partie du supplément Pas à Pas 2024 réalisé avec le soutien institutionnel de Procter & Gamble.


Références
Gardner-Medwin JM, Dolezalova P, Cummins C, Southwood TR. Incidence of Henoch-Schönlein purpura, Kawasaki disease, and rare vasculitides in children of different ethnic origins. Lancet. 2002 Oct 19;360(9341):1197-202. DOI: 10.1016/S0140-6736(02)11279-7.
Avramescu M, Lahoche A, Hogan J, et al. To biopsy or not to biopsy: Henoch-Schönlein nephritis in children, a 5-year follow-up study. Pediatr Nephrol. 2022 Jan;37(1):147-52. DOI: 10.1007/s00467-021-05086-9.
Trautmann A, Vivarelli M, Samuel S, et al. IPNA clinical practice recommendations for the diagnosis and management of children with IgA nephropathy and iga vasculitis nephritis. sous presse dans pediatric nephrology.
Narchi H. Risk of long term renal impairment and duration of follow up recommended for Henoch-Schönlein purpura with normal or minimal urinary findings: a systematic review. Arch Dis Child. 2005 Sep;90(9):916-20. DOI: 10.1136/adc.2005.074641.
Ebert EC. Gastrointestinal manifestations of Henoch-Schönlein Purpura. Dig Dis Sci. 2008 Aug;53(8):2011-9. DOI: 10.1007/s10620-007-0147-0.